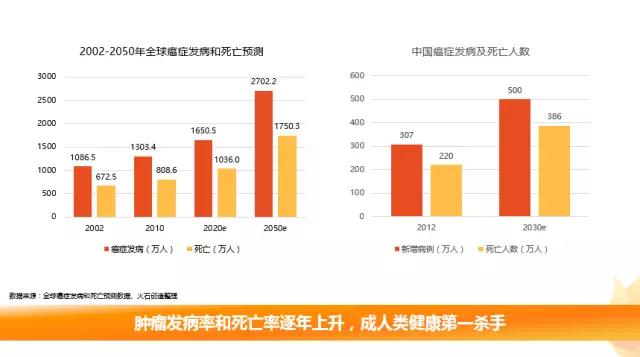
癌症发病率逐年上升,不容忽视
随着全球人口不断的增长与老龄化的加剧,肿瘤的发病率和死亡率逐年上升,已经成为危害人类健康的第一杀手。据不完全统计,2012年我国新增癌症病例约307万例,其中约220万人死于癌症,预计到2030年我国新增癌症病例将达到500万人,死亡人数将达到386万人。
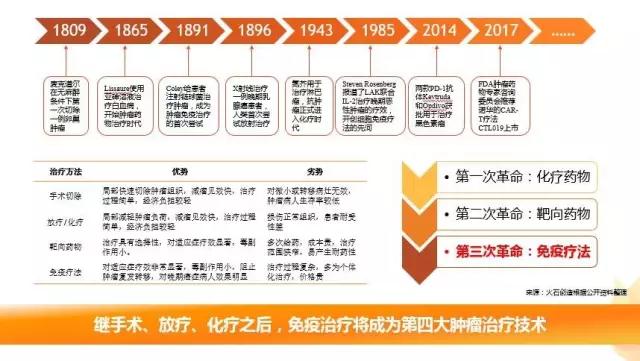
免疫治疗成为第四大肿瘤治疗技术
自人类首次认识肿瘤以来,先后开发了手术切除、化疗、放疗等治疗手段。然后随着肿瘤学与免疫学发展的不断深入,围绕人体免疫系统来治疗肿瘤逐步被接受。2013年《Science》将肿瘤免疫治疗评选为年度十大科学突破之首。
在现代肿瘤学的百余年历程中,先后实现了三次革命性的突破。第一次是细胞毒性化疗药物的发现,改变了肿瘤治疗依靠手术和放疗的局面;第二次是靶向治疗,提高了抗肿瘤药物的治疗指数,为精准医疗奠定了基础;第三次就是调动患者全身天然免疫功能的免疫疗法。
全球首个FDA批准的CAR-T治疗产品CTL019在美国上市
8月30日晚11时许,美国食药监局(FDA)官网发布消息称,他们做出历史性决定,批准了美国境内首款基因治疗方案,即诺华公司的CAR-T治疗产品-CTL019上市。据《华盛顿邮报》等媒体报道,诺华公司称,CTL019定价为47.5万美元每位患者,如果患者在一个月的治疗后没有效果,将不用支付治疗费用。

FDA官网消息称,涵盖63名难治性或复发性白血病患儿或年轻患者的临床试验显示,CTL019治疗后,患者三个月内的缓解率达到83%,证实了该治疗方案或药品的安全性和有效性。FDA的生物制剂评估中心总监Peter Marks博士说:“Kymriah是首例以细胞为载体的基因治疗方法,可满足儿童和年轻患者的治疗需求。这类患者以往存在非常有限的治疗选择,而Kymriah的出现为这些患者提供了一种新的治疗方案,更重要的是,在该治疗方案的临床试验中显示出有希望的高缓解率和存活率。Kymriah的上市具有里程碑意义,标志着CAR-T细胞治疗的疗效、安全性和整个商业化流程都获得了FDA的正式认可,部分淋巴肿瘤细胞患者迎来了靠谱的“活化细胞治疗药物”;同时还会对其他细胞治疗(T-CRT/TIL)产生积极影响,加速更多细胞治疗产品的上市,造福肿瘤患者。
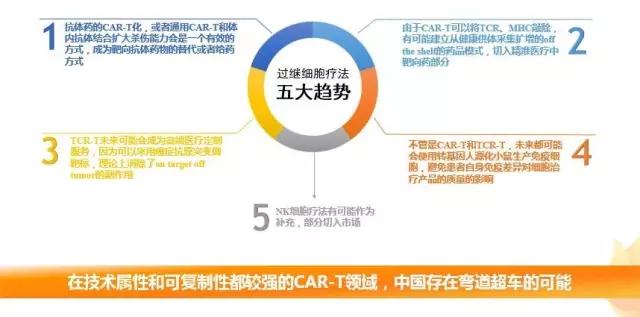
中国跻身CAR-T临床研究第一梯队
美国是全球开展CAR-T细胞疗法临床试验最早的国家,在2010年以前,全球注册的CAR-T临床试验基本集中在美国。到2012年开始,中国301医院开始注册CAR-T临床试验。据ClinicalTrial.gov的数据显示,截至今年8月,中国登记开展的CAR-T临床研究项目达110项,已经在数量上超过欧洲,仅次于美国,超过全球注册总数的40%,并呈逐年递增趋势。随着中国跻身CAR-T临床研究第一梯队,我们认为,在技术属性和可复制性都较强的CAR-T领域,我国存在弯道超车的可能性。
益养在CAR-T领域的研究进展

2017年6月,我司作为发起者的肺癌CAR-T细胞治疗I期临床试验研究项目《晚期肺癌标准治疗后应用CAR-T细胞治疗的安全性和毒性的探索:一项单臂、单中心的Ⅰ期临床研究》已通过中山大学肿瘤医院伦理委员会审查,获得临床试验开展批件。
当前我司已完成用于治疗急性淋巴细胞性白血病和肺癌的CAR-T细胞的制备,病毒滴度及原代T细胞转导效率均达到国际水平。且已证实PD-1 FR 和PD-L1 CAR修饰的T细胞在体外对PD-L1阳性细胞都显示出强大的杀伤作用。
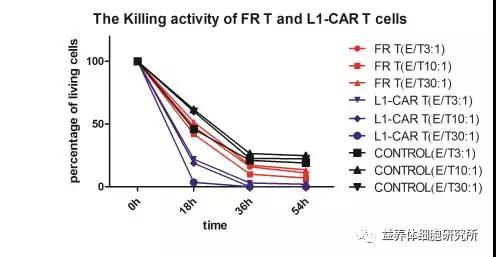
FR-T和CAR-T体外杀伤实验结果图

 020-38473605
020-38473605



